배터리의 원리를 이해하기 위해서라면 전기화학을 이해하는 것이 가장 중요한데요.
전기화학 (electrochemistry)은 화학 반응과 전기의 관계를 배우는 학문으로 물리화학의 작은 branch로 생각할 수 있습니다.
전기화학에서 가장 중요한 개념은
1. 특정 화학 반응은 전기를 생성한다.
2. 전기는 특정 화학 반응이 일어나게 만든다.
또한, 산화-환원 반응 (oxidation-reduction reaction)이 전기화학의 기초 화학 반응인데요.

산화 반응 (oxidation)이란 산소를 얻고 전자를 잃는 반응이고
환원 반응 (reduction)이란 산소를 잃고 전자를 얻는 반응입니다.
따라서, 산화-환원 반응에서 전자가 원소 사이를 움직인다라는 것을 알 수 있습니다.
그래서 전기 (electricity)가 무엇인가?
바로 전자 (electron | e‾)의 움직임 (이동)입니다.
산화-환원 반응에서 원소 사이를 움직이는 전자가 바로 저희가 알고있는 전기가 되는 것입니다.
Galvanic Cell (Voltaic Cell)
화학 반응을 통해 전기를 생성하는 갈바닉 셀에 대해서 알아보겠습니다.
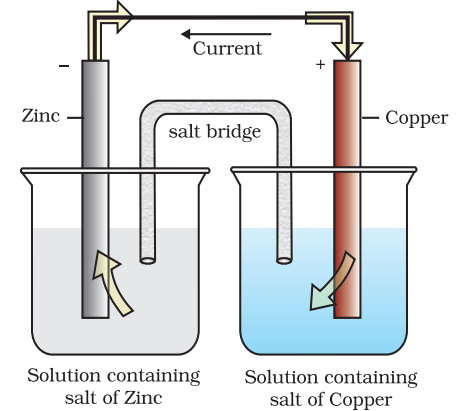
여기서 두 가지의 전극이 나오는데요. 산화 전극을 anode, 환원 전극을 cathode라고 부릅니다.
Zn이 전자 (e‾)를 끌어당기는 힘이 Cu가 전자를 끌어당기는 힘보다 약하기에
Zn이 전자를 잃고 산화 (oxidize)하게 됩니다.
반대로 Cu는 전자를 얻고 환원 (reduce)하고 되는 것이죠.
여기서 전해 셀 (electrolytic cell)이라는 개념이 새롭게 등장하게 됩니다.
이는 비자발적으로 전기 에너지를 공급받아 화학 반응이 발생하는 것인데요.
이를 전기분해 (electrolysis)라고도 합니다. 전기분해는 비자발적 화합물의 분해 반응을 직류 전기를 이용하여 발생하도록 하며 원하는 물질을 얻는 기술이죠.
예를 들어 H₂O → H₂ + O₂ 반응은 비자발적인 화학 반응입니다.
이런 경우, 배터리를 활용하여 oxygen에서 전자를 끌어당겨 hydrogen에게 보낼 수 있습니다.
이렇게 비자발적 화학 반응에서 전기 에너지를 공급 받고 생성하게 되는 것이죠.
마지막으로, cell notation에 대해 이야기 해보겠습니다.
cell notation은 가바닉 셀의 화학적 반을을 짧게 줄인 것입니다.
만약 갈바닉 셀의 산화 반응이 Zn(s) --> Zn2+(aq) + 2e‾이고
환원 반응이 Cu2+(aq) + 2e‾ --> Cu(s) 라면
Zn(s) | Zn2+(aq) || Cu2+(aq) | Cu(s)
이렇게 작성한 것이 cell noation 입니다.
cell notation은 oxidation (anode) || reduction (cathode) 순서로 작성해야합니다.