고등 화학은 화학과, 화학공학과, 생물과, 신소재공학과에 재학할 때 아주 중요한 기초가 되는 과목이다. 나도 복습을 하면서 화학 개념을 다지고자 AP Chemistry를 기반으로 고등화학 정리를 해보려고 한다.
AP Chemistry에는 Thermochemistry, Bonding, Kinetics, Equilibrium 등 기본적인 화학의 기초를 물어보는 시험이다. 대학생 입장에서는 쉽지만 고등학생 입장에서는 아주 쉽지만은 않은 내용들이 많이 포함되어있다.
오늘은 아주 간단한 공식들과 개념만 정리해볼 예정이다.
원자 Atoms
원자 (Atom)이란, 물질을 이루는 기본적인 입자이다.
원자는 가장 작은 화학적 단위로 더이상 쪼개지거나 작아질 수 없다.

여기에 새로운 개념들이 나오게 되는데
Electron (e¯ | 전자) 은 마이너스 (-)의 전하를 가지고 있는 원자의 구성 요소이며, 원자의 핵 (Nucleus) 주위를 맴돈다.
Proton (양성자)는 플러스 (+) 전하를 가지고 있는 원자의 구성 요소로 핵 안에 소속되어 있다.
Neutron (중성자)는 전하를 가지고 있지 않는 원자의 구성 요소로 양성자와 핵 안에 소속되어 있다.
원자는 같은 수의 양성자와 전자를 가지고 있다. 그래서 기본적인 원자는 전하를 크게 띠고 있지 않다.
하지만, 대부분의 경우 원자의 양성자와 전자 수가 다른 경우가 많은데 이것을 이온 (Ion)이라고 한다.
원자의 구조

원자의 구조에 대한 다양한 모델 (model)이 있다.
The Thompson model (Plum Pudding): Thompson이 추측한 원자의 구조로 양성자가 중앙에 모여있고 그것을 균일하게 둘러싼 전자가 존재한다. [= negatively charged electrons evenly distributed through a positively charged medium]
The Rutherford model: Rutherford가 실험으로 증명한 결과는 "원자의 대부분의 공간은 비어있다"로 많은 양의 전하가 원자의 중앙에 몰려있다. [= most of the volume of the atom is empty space, with a large amount of charge concentrated at the centre of the atom]
The Bohr model: Bohr은 우리가 지금 배우는 원자의 구조이며, 중앙에 위치한 핵 (nucleus)에 양성자와 중성자로 구성되어 있고, 각 다른 궤도로 (태양계처럼) 전자가 핵을 둘러싸며 움직이고 있다. [= central charge as a nucleus composed of distinct proton and neutron particles. Electrons as discrete particles that orbited the nucleus along distinct paths]
원소 분석하기

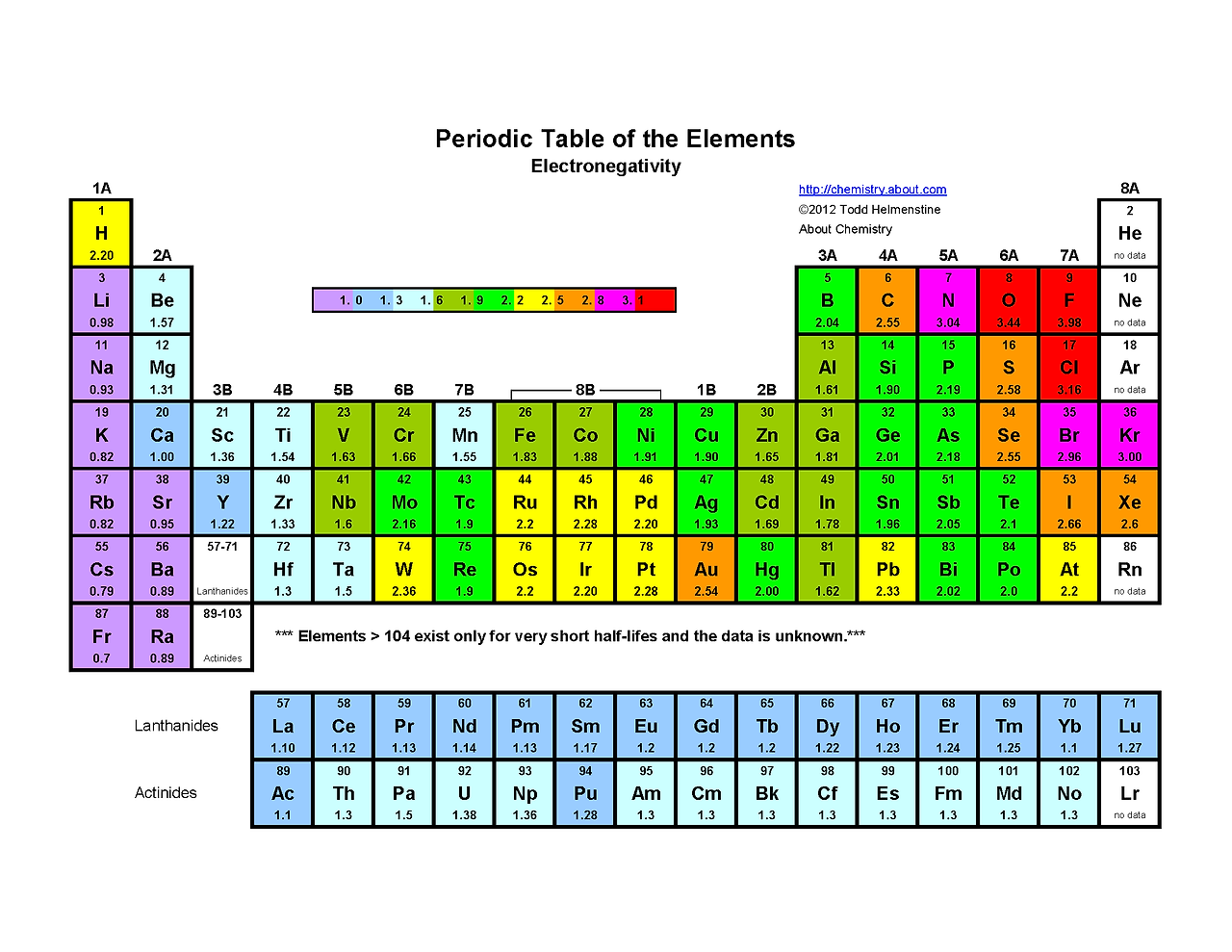
개인적인 경험으로 주기율표 (periodic table)을 모두 이해하기는 쉽지 않았다.
그래도 주기율표에서 아주 중요한 몇가지 개념을 설명해 보도록 하겠다.
일단, 주기율표를 보면 각 원소 별로 다양한 숫자와 함께 작성되어 있는 것을 알 수 있다.
오른쪽 상단에 위치한 숫자가 원자 번호 (Atomic number)이다.
원자 번호는 원자의 고유 번호로 다른 원자와 절대 겹치지 않는다.
그리고 이 원자 번호는 각 원자가 보유한 양성자 (proton)의 수를 뜻한다.
He (Helium | 헬륨)의 원자 번호는 2이기 때문에 2개의 양성자를 가지고 있다는 의미이고, 양성자와 전자의 갯수는 동일하기에 2개의 전자를 가지고 있다는 것을 이해할 수 있다.
왼쪽 상단에 위치한 숫자가 원자 질량 (Atomic mass)이다.
주기율표에 따라 다르기도 하지만, 대부분 알파벳 밑에 위치한 경우가 많다.
원자 질량은 원자 핵을 구성한 양성자와 중성자의 갯수이다.
C (Carbon | 탄소)를 예시로 원자 번호는 6이고, 원자 질량은 12이다.
이런 경우 6개의 양성자가 있다는 것을 알 수 있고, 12 - 6 = 6으로 총 6개의 중성자가 있다고 이해하면 된다.
다른 숫자들의 경우, 추후에 더욱 이야기를 해보도록 하겠다.
주기율표를 보면 항상 의문이 드는 것이 있을 것이다. "주기율표는 왜 이렇게 알록달록하지?
주기율표의 각 색은 특징이 비슷한 원소들을 하나로 묶은 그룹(Group)이다.
Group IA (알칼리금속 | Alkali Metals): 은백색 금속을 뜻하는 그룹으로, 반응성이 가장 크다.
Group IIA ( 알칼리토금속| Alkaline Earth Metals): 은백색이고 알칼리 금속 다음으로 가볍고 무르다.
Group B (전이 금속 | Transition Metals)
Group VIIA (불활성기체 | Noble Gases): 반응도가 가장 낮은 원소이다.
Group VIIA (할로겐 | Halogens): 물에 쉽게 녹도 소금과 같은 염(鹽)을 만든다.
여기까지 간단하게 원소에 대해서 배워보았다.
다음 시간에는 결합 (Bonding)에 대한 이야기를 위주로 할 예정이다.